2023年2月10號,華夏源(上海)生物科技有限公司自主研發的I類生物制品,“ELPIS人臍帶間充質干細胞注射液”(受理號:CXSL2200581),正式獲得國家藥監局藥品審評中心(CDE)的藥物臨床試驗批準通知(通知書編號:2023LP00238),予以準許開展Ib期臨床試驗。
新適應癥主要用于慢加急性(亞急性)肝衰竭的治療,這是繼華夏源“ELPIS人臍帶間充質干細胞注射液”中、重度斑塊型銀屑病和重度狼瘡性腎炎適應癥獲批后斬獲的又一新適應癥,這是華夏源干細胞新藥產品的第三個應用方向,也將為慢加急性(亞急性)肝衰竭帶來新的治療選擇。
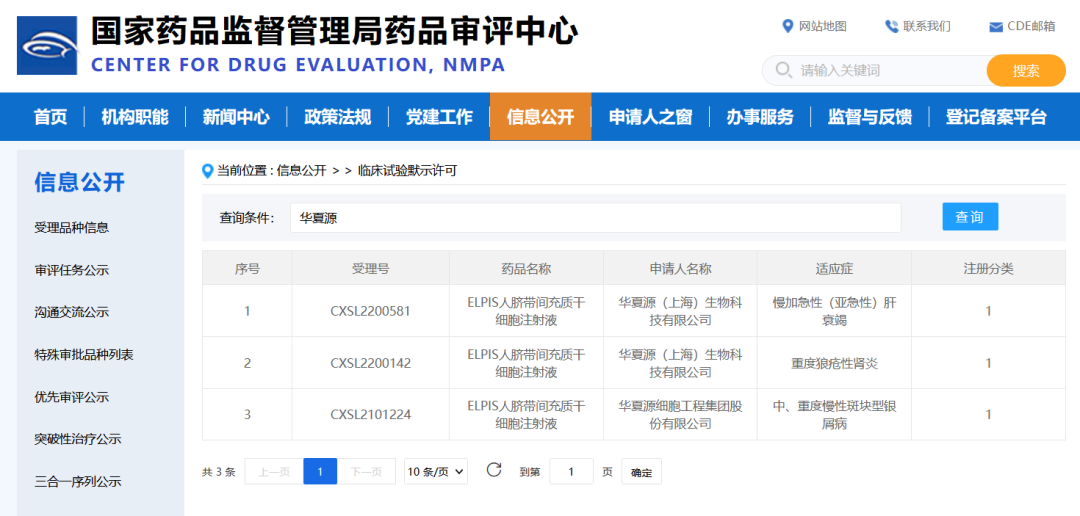
△ 國家藥監局官網:華夏源“ELPIS人臍帶間充質干細胞注射”獲臨床試驗默示許可

△ 國家藥品監督管理局藥物臨床試驗批準通知
CDE,即國家藥品監督管理局藥品審評中心,是國家食品藥品監督管理局藥品注冊技術審評機構,按照國家食品藥品監督管理局頒布的藥品注冊管理有關規章,負責組織對藥品注冊申請進行技術審評,組織開展相關的綜合評審工作。
IND,即新藥臨床試驗,是藥物研發企業以注冊目的,在藥品正式上市前,向CDE提供足夠信息來證明藥品在人體進行試驗是安全的,以及證明針對研究目的的臨床方案設計是合理的而開展的人體臨床試驗。
我國是肝病大國,每年早、中期肝衰竭病人超百萬,晚期病人約45萬,其中慢加急性(亞急性)肝衰竭(ACLF)占肝衰竭的70%-80%,發病呈逐年上升趨勢,ACLF患者體內產生的大量促炎因子,將導致機體出現系統性炎癥反應綜合征(SIRS),SIRS是ACLF高死亡率的重要原因,減少促炎因子和壞死的肝細胞是治療ACLF的關鍵。
目前,ACLF的內科治療尚缺乏特效藥物和手段,原則上強調早期診斷、早期治療,采取相應的病因治療和內科綜合治療措施,并積極治療并發癥。人工肝治療可為肝細胞再生及肝功能恢復創造條件,是目前治療ACLF的有效方法之一,但卻不能逆轉肝細胞數量日益減少所導致的肝功能減退;肝移植作為目前救治肝衰竭成功率最高的治療措施,由于肝源不足、費用高昂、需要長期抗排異治療等原因也存在一定的局限性。
干細胞治療是通過移植來替換、修復患者損傷的細胞,或發揮免疫調節、組織修復等功能,以到達治療疾病的目的。
ELPIS人臍帶間充質干細胞基于其免疫調節功能,可抑制多種過度激活的免疫細胞,保持免疫平衡,改善免疫細胞過度活化導致炎癥因子大量釋放;其次ELPIS可以通過旁分泌、免疫調節作用減輕肝臟炎癥反應并調節肝星狀細胞的增殖和凋亡,減少膠原的沉積從而減輕肝臟纖維化改善肝臟的微環境;并通過HGF、VEGF等因子的分泌抑制肝細胞凋亡以促進肝再生,從而發揮一個“組織修復的作用”。
因此,ELPIS人臍帶間充質干細胞可以在肝臟壞死的“急性治療”期作為橋接手段發揮免疫調節及促進肝臟再生的“過渡”作用,也可在恢復期輔助其他治療,減少肝纖維化、肝硬化的發生。ELPIS人臍帶間充質干細胞的這些作用特點決定了其治療ACLF的優勢。
